Anwendungsnotiz: Analyse der Größenverteilung von Influenza-Viruspartikeln mit der CPS Scheibenzentrifuge

Influenzavirenproduktion für saisonale Grippeimpfungen
von Michael M. Pieler und Michael Wolff, Otto-von-Guericke-Universität, Magdeburg
Impfen ist eine wichtige Maßnahme, um den Ausbruch von Grippeviren unter Kontrolle zu bringen. Daher werden große Anstrengungen unternommen, Produktionsprozesse zu optimieren und neue Wege zur Herstellung von Impfstoffen zu finden. Ein zunehmend wichtiger Faktor in neuen Produktionsprozessen ist die Aggregation von Viruspartikeln. Je nach angewendetem Verfahren während des Downstream Processing (DSP), z. B. (Crossflow-) Filtration, Chromatografie oder Zentrifugation, können die Verluste durch Partikelaggregation enorm sein. Deshalb werden aktuell verschiedene Prozessbedingungen untersucht, um ihren Einfluss auf die Viruspartikel-Aggregation zu bestimmen und Erkenntnisse über die dadurch entstehenden Effekte zu gewinnen.
Methode
Zuerst wurde die Größenverteilung der in MDCK-Zellen produzierten Grippevirenstämme (A/Puerto Rico/8/34, A/Wisconsin/67/2005, A/Eq/Newmarket, und B/Malaysia/2506/2004) bestimmt. 1,2,3 Anschließend wurden sie mittels differentieller zentrifugaler Sedimentation mit einer Scheibenzentrifuge Typ DC24000 UHR von CPS analysiert (Neumann et al.4). Die Messungen wurden bei 24000 rpm durchgeführt, mit einem Saccharosegradienten zwischen 2 und 8% w/v in 1x Phosphat-gepufferter Salzlösung (1x PBS). Der Gradient wurde für 30 min äquilibriert; pro Analyse wurden 200 µL der Probenflüssigkeit injiziert. Die Messzeit pro Probe betrug ca. 15 Minuten.
In den Abbildungen sind die Probenwerte jeweils als Mittelwert aus drei Messungen an der gleichen Probe (technical replicate) in neuen Gradienten dargestellt.
Ergebnis und Diskussion
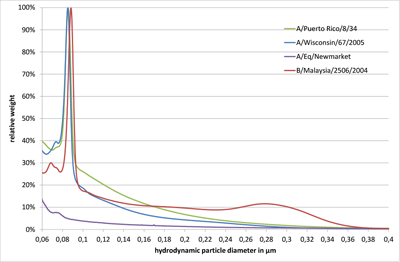
Alle getesteten Grippevirenstämme zeigten einen großen Peak im Größenbereich 80 – 90 nm. Für B/Malaysia/2506/2004 wurde ein weiterer breiter Peak bei ca. 280 nm beobachtet (Abb. 1). Außerdem wurden Peaks um 70 – 80 nm verzeichnet, was eventuell auf Zellrückstände oder Virenfragmente zurückgeführt werden kann. Die Größenverteilung einer 20fach konzentrierten A/Puerto Rico/8/34-Probe nach einer 1:3-Verdünnung in 10 mM Tris-HCl pH 7,4 und einer 0,45-µm-Filtration zeigten kaum Abweichungen im Vergleich zur ursprünglich konzentrierten Virenprobe (s. Abb. 2, blaue und grüne Linie).
Dennoch zeigte die Auswertung von aus dem Membranadsorber und der Partikel-basierenden Matrix eluierten Viruspartikeln mit äquivalenten Funktionsgruppen und ähnlichen Backbone-Strukturen unterschiedliche Partikelgrößenverteilungen. Die aus dem Membranadsorber eluierten Viruspartikeln zeigten einen scharfen Peak bei 85 nm, genau wie das geladene Material (s. Abb. 2, blaue Linie). Die aus der Partikel-basierenden Matrix eluierten Viruspartikeln zeigten dagegen einen breiten Peak von ca. 80 nm - 2 μm (s. Abb. 2, violette Linie, Größenangaben nur bis 400 nm).
Fazit
Kleinste Abweichungen in Prozessbedingungen können zu signifikanten Veränderungen in der Größenverteilung von Viruspartikeln führen. Dies wiederum kann den Ertrag und die Reinheit erheblich mindern. Eine erhöhte Aufmerksamkeit hinsichtlich Virusaggregation kann die Herstellungsprozesse von Impfstoffen positiv beeinflussen und deren Leistungs- und Widerstandsfähigkeit begünstigen. Die CPS DC24000 UHR Scheibenzentrifuge ist hierfür ein nützliches Werkzeug. Um jedoch ein umfassendes Bild über vorliegende Virusaggregation zu bekommen, ist eine Kombination unterschiedlicher Methoden unabdingbar.
Referenzen
- Genzel, Y., Behrendt, I., König, S., Sann, H. & Reichl, U. Metabolism of MDCK cells during cell growth and influenza virus production in large-scale microcarrier culture. Vaccine 22, 2202–2208 (2004).
- Genzel, Y., Dietzsch, C., Rapp, E., Schwarzer, J. & Reichl, U. MDCK and Vero cells for influenza virus vaccine production: a one-to-one comparison up to lab-scale bioreactor cultivation. Appl. Microbiol. Biotechnol. 88, 461–475 (2010).
- Genzel, Y., Fischer, M. & Reichl, U. Serum-free influenza virus production avoiding washing steps and medium exchange in large-scale microcarrier culture. Vaccine 24, 3261–3272 (2006).
- Neumann, A. et al. New method for density determination of nanoparticles using a CPS disc centrifugeTM. Colloids Surf. B Biointerfaces 104, 27–31 (2013).